干扰素刺激基因(STING)对于感知细胞质DNA和启动针对微生物感染和肿瘤的先天免疫应答至关重要。氧化还原稳态是所有生命系统中存在的氧化反应和还原反应的平衡。然而,细胞内氧化还原状态如何控制STING激活尚不清楚。
近日,山东大学赵伟团队在Nature Immunology 在线发表题为“Redox homeostasis maintained by GPX4 facilitates STING activation”的研究论文,该研究显示了谷胱甘肽过氧化物酶4(GPX4)维持的细胞氧化还原稳态是STING激活所必需的。 GPX4缺乏会增强细胞脂质过氧化作用,因此特别抑制cGAS–STING途径。相应地,GPX4缺乏抑制单纯疱疹病毒1(HSV-1)诱导的先天抗病毒免疫反应并促进体内HSV-1复制。
从机制上讲,GPX4失活增加了脂质过氧化的产生,这导致C88处的STING羰基化,并抑制了其从内质网(ER)转运至高尔基复合体。因此,细胞应激诱导的脂质过氧化作用特别减弱了STING DNA的传感途径,表明GPX4通过维持脂质的氧化还原稳态来促进STING活化。

先天性免疫的最佳激活对于控制传染病和肿瘤至关重要。STING是先天免疫的中枢受体,可感知第二信使cGAMP。 cGAS从基因组DNA损伤中识别出胞质病原体衍生的DNA(例如病毒DNA)或自身DNA,然后激活STING。
在静止状态下,STING作为同型二聚体锚定在ER膜内。cGAMP的结合触发STING从ER转运至ER-高尔基体中隔室和高尔基体,在那里募集TANK结合激酶1(TBK1)和干扰素调节因子3(IRF3),导致产生I型干扰素。然后,I型干扰素激活JAK–STAT通路并诱导众多干扰素刺激基因(ISG)的表达,这些基因编码抗病毒介质,例如ISG15,ISG56,ISG54和粘液病毒抗性蛋白1(Mx1),从而建立细胞抗病毒状态。
因此,最佳的STING激活对于维持免疫稳态和消除入侵病毒至关重要。除其在启动宿主防御入侵病毒的基本作用外,越来越多的证据表明STING在多种疾病中具有致病作用,例如自身免疫性疾病,衰老相关疾病和癌症。
氧化还原稳态是生理细胞稳态的重要组成部分。氧化还原稳态的受损,例如脂质过氧化物丰度的失衡,与多种病理状况相关,包括病毒性疾病和癌症。脂质氢过氧化物酶GPX4是一种独特的酶,可通过将高反应性脂质氢过氧化物(LOOH)还原为非反应性脂质醇来保护细胞免受膜脂质过氧化作用并维持氧化还原稳态。
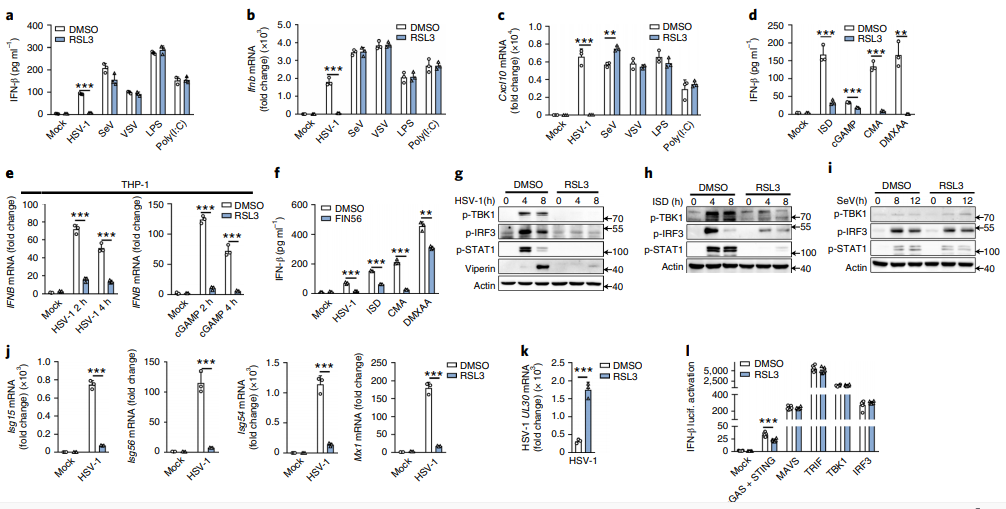
GPX4抑制选择性地减弱cGAS–STING途径(图源自Nature Immunology )
GPX4是铁死亡的关键上游调节因子,这是一种受调节的细胞死亡形式,其特征在于铁依赖的LOOH积累至致死水平。因此,GPX4通过中断脂质过氧化链反应来预防铁死亡。作为关键的胞质过氧化抑制蛋白,GPX4活性与多种疾病有关,包括变性疾病和癌症。髓系谱系细胞中有条件的Gpx4缺失可调节脂质过氧化依赖的caspase-11活化和Gasdermin D(GSDMD)介导的多发性脓毒症中的凋亡。GPX4维持细胞内氧化还原稳态控制STING激活的方式仍然未知。
在这里,该研究表明GPX4是激活cGAS-STING途径和随后针对DNA病毒的先天免疫应答所必需的。GPX4缺乏症会增强脂质过氧化作用,从而促进STING羰基化并抑制其从ER向高尔基体的转运。该研究结果表明脂质过氧化是细胞应激(例如病毒感染)过程中发生的生理过程,并暗示GPX4通过维持氧化还原稳态来许可STING激活。该研究工作揭示了STING激活的新机制,并提出了一种新的方法来调节STING依赖性免疫病理学。